Sélection génomique, édition des génomes
« Les progrès obtenus grâce à ces différentes méthodes et la connaissance détaillée de nombreux SNPs ont permis de réfléchir à une méthode de sélection génomique. D’une manière générale, la sélection traditionnelle consiste à effectuer des croisements, à mesurer le phénotype des descendances (en espérant voir apparaître un trait intéressant dans la combinaison des caractères parentaux), puis à croiser à nouveau les individus les plus intéressants entre eux…
Avec la sélection assistée par marqueurs, les opérations peuvent être un peu plus rapides, mais les champs d’investigation sont très précis et seul un petit nombre de gènes peut être suivi. Avec la sélection génomique, les scientifiques utilisent l’information contenue dans le génome entier pour former des modèles permettant de prédire le phénotype (les « traits ») d’une plante à partir de son génotype (le polymorphisme de l’ADN). Il est alors possible d’effectuer un travail de sélection simplement sur la base des marqueurs moléculaires et sur l’information large contenue dans le génome. Comme le prix d’un génotypage est très bas aujourd’hui, il est plus intéressant et plus efficace de procéder de cette façon plutôt que par les méthodes qui font appel au phénotypage et à un gros travail d’expérimentation. L’expérimentation est nécessaire et indispensable au début, mais seulement sur une partie de la population, qui fournit les informations nécessaires pour prédire, avec une bonne précision, le phénotype sur l’ensemble de la population. Au final, il faut aussi valider le phénotype des individus jugés les plus intéressants sur la base de leur génotype. »
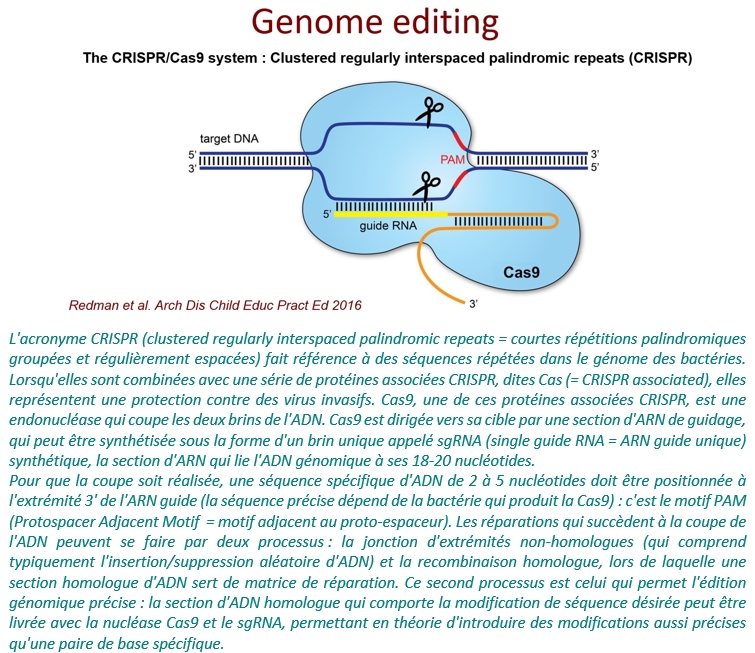
« L’édition des génomes est réalisée grâce à une méthode dénommée CRISPR-Cas9, inventée il y a quelques années et fondée sur l’utilisation d’une protéine – Cas9, une enzyme qui permet aux bactéries de se protéger des attaques virales. Utilisée comme vecteur d’entrée, cette enzyme agit comme une paire de ciseaux, en coupant l’ADN et en le réparant. La coupure – ou édition génomique – est effectuée dans des régions spécifiques, « reconnues » par une section particulière d’ARN (ARN guide).
Cette technique d’édition de gènes par CRISPR représente un outil de choix pour améliorer des caractéristiques de plantes cultivées, et il existe de nombreuses façons d’utiliser cette technologie, selon les différentes modalités de coupure et de réparation des séquences complémentaires de bases constitutives des brins d’ADN.
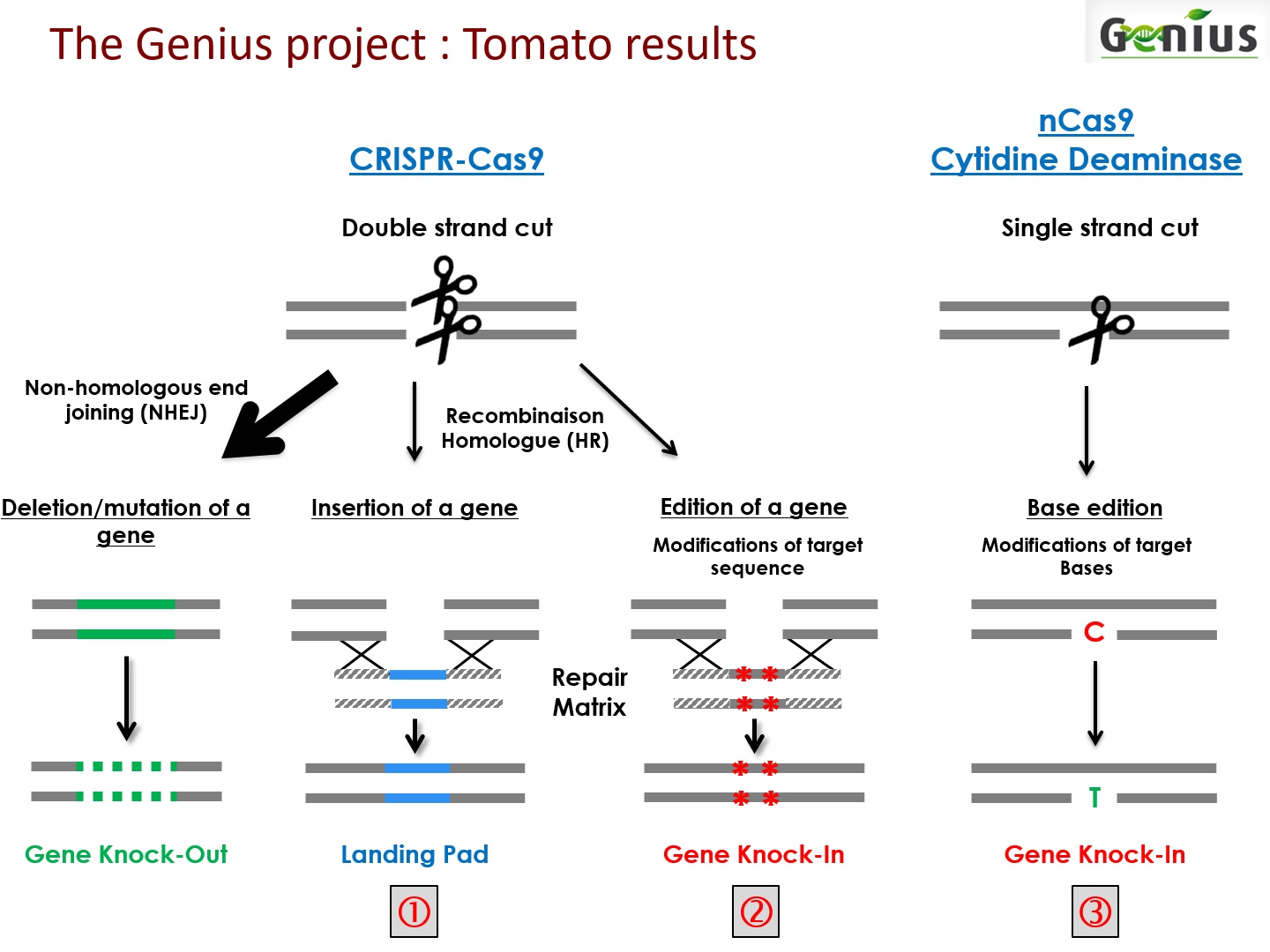
Le système CRISPR permet de générer des cassures d’ADN double-brins dans le génome. Ces cassures peuvent être réparées selon deux voies :
• par jonction d'extrémités non homologues (NHEJ) ; cette technique majoritaire et proche des méthodes OGM traditionnelles produit des erreurs de réparation et permet de générer efficacement un « knock-out » dans un gène, de manière à le rendre non-fonctionnel. Ce type d’approche peut être intéressant dans le cas d’un gène dont les effets sont négatifs, comme peut l’être une sensibilité à une maladie ou à un stress abiotique. Les effets de cette technique, relativement brutale par comparaison avec les systèmes dérivés, peuvent cependant s’avérer assez aléatoires.
• par recombinaison homologue (HR), une technique minoritaire mais qu’il est possible de favoriser en apportant une matrice de réparation qui comporte à ses extrémités des régions d’homologie avec l’ADN cible. Il est ainsi possible de procéder :
o à l’insertion d’un gène, introduit précisément à l’endroit voulu (Landing Pad) dans le génome. Le gène n’est pas « cassé » mais modifié, par le changement de la séquence d’acides aminés qui constituent la protéine. La régulation est beaucoup plus fine que dans le cas du knock-out.
o à l’édition de gènes, une technologie intéressante par laquelle il est possible d’insérer une matrice de réparation avec de petites modifications très précises de la séquence. Cette matrice va servir de modèle/pansement pour la réparation. Par cette stratégie (dite « knock-in »), on peut introduire des petites modifications dans le génome. »
« Bien que l’édition de gènes par recombinaison homologue soit particulièrement attractive pour l’amélioration des plantes cultivées, la technique reste une approche difficile à maitriser, qui ne donne qu’un faible pourcentage de réussite des insertions ciblées. Pour pallier cette limite, de nouveaux outils dérivés de CRISPR standard ont été mis au point, qui mettent en œuvre des approches légèrement différentes dans lesquelles l’enzyme Cas9 est partiellement inactivée, de manière à ne couper qu’un seul des deux brins d’ADN et à permettre le remplacement d’une base par une autre. Cela permet l’édition du gène au niveau de ses bases, un outil très efficace pour procéder à des modifications précises et prévisibles « à la base près ». Cette méthode, précise, ciblée, simple et économique, limite en outre l’apparition de mutations indésirables susceptibles de survenir avec la méthode CRISPR classique. »
« Les chercheurs ont développé ces trois technologies pour la tomate, qui permettent d’obtenir des résultats fiables, sur tous types de gènes, sur une durée de six mois. Plusieurs travaux ont déjà été publiés, notamment sur la mise au point de variétés résistantes à la moucheture bactérienne, au TYLC et à l’oïdium, en utilisant les méthodes CRISPR. Un aspect très intéressant de l’édition des génomes est la possibilité qu’offre la méthode de travailler non sur une seule mutation à la fois mais sur plusieurs mutations en même temps. Des travaux menés en 2018 sur la « re-domestication » de Solanum pimpinellifolium au travers de 6 gènes ciblés simultanément (croissance de la plante, croissance du fruit, forme ovale, poids du fruit, nombre de fruits, teneur des fruits en lycopène) ont montré que l’édition des génomes permettait d’obtenir des plantes qui produisaient dix fois plus de fruits, des fruits trois fois plus gros et une teneur en lycopène des fruits 500 fois plus importante. »
« Il importe cependant de noter que le taux de réussite de la méthode CRISPR n’est pas absolu et diminue, logiquement, avec le niveau de finesse ou de précision exigé. Si le knock-out d’un gène est relativement facile à obtenir, le remplacement ciblé de quelques nucléotides est plus complexe. La technologie ne permet pas encore de procéder facilement à tous les remplacements : certaines conversions de bases à bases (Adénine, Thymine, Cytosine et Guanine) ne fonctionnent pas.
Par ailleurs, un des points essentiels de la méthode repose également sur la connaissance précise des gènes à modifier. Malgré l’énorme travail déjà réalisé, les chercheurs n’ont pas identifié la totalité des gènes : chaque caractère, chaque fonction peut faire intervenir plusieurs dizaines de gènes et, si l’on connait les 35 000 gènes (environ) de la tomate, on ne sait pas pour autant en détail ce que leurs variations provoquent dans l’expression phénotypique au champ. Les chercheurs estiment qu’un tiers environ d’entre eux n’a pour l’instant pas de fonction connue, et que beaucoup interviennent dans des processus de régulation en cascade, mais on ignore quels pourraient être les effets (résistance, adaptation particulière, etc.) des modifications tant qu’elles n’ont pas été dûment soumises à l’expérimentation.
Concernant les résistances aux maladies, la recherche dispose aujourd’hui d’une cinquantaine de gènes caractérisés. Pour le poids du fruit, une trentaine au moins de gènes importants ont été identifiés, parmi lesquels pour l’instant quatre seulement ont été caractérisés. Concernant les arômes, les chercheurs ont pu identifier une dizaine de gènes, tandis que pour la forme des fruits, un caractère simple, quatre gènes ont été caractérisés, qui « expliquent » environ 95% des formes observées. À l’inverse, les caractères de résistance au stress salin, au stress hydrique, à la chaleur, etc. sont très complexes et font intervenir de nombreux gènes, de sorte qu’il est très difficile d’identifier et de hiérarchiser les gènes responsables des réactions aux différents stress. »
« Pour comprendre les limites de la méthode, il est essentiel d’appréhender correctement la différence entre le gène – le trait ou la fonction pour laquelle il code – et le fait que sa modification induise une variation importante ou significative dans l’expression du caractère. Le fait qu’un gène intervienne dans une fonction n’implique pas nécessairement qu’il soit déterminant pour cette fonction. Il appartient donc aux chercheurs de trouver quel est le gène-cible dont la régulation est précisément un facteur limitant pour modifier le trait étudié. Pour résumer, les connaissances que les chercheurs ont du génome en matière de résistances sont très bonnes, mais concernant les capacités d’adaptation des cultures aux conditions extérieures, les connaissances restent pour l’instant très quantitatives, et doivent être affinées pour quelques cibles déjà identifiées. En matière de qualité, les critères sont extrêmement nombreux : les processus relatifs aux sucres, aux acides ou aux arômes sont assez bien connus. En revanche, pour les phénomènes liés à la viscosité, un paramètre capital pour l’industrie de la tomate transformée, un travail important reste à accomplir, notamment en amont, au niveau physiologique, afin de bien comprendre quels paramètres et quels processus entrent en jeu, avant d’entreprendre une recherche qui pourrait porter éventuellement sur des gènes responsables de la taille des cellules mais aussi sur d’autres caractères qui restent également à déterminer.
Enfin, la teneur des fruits en lycopène est un domaine où les connaissances en termes du génome sont bonnes. La difficulté réside dans le fait d’accroître cette teneur dans la pulpe du fruit, alors que la majeure partie du lycopène présent dans le fruit se trouve contenue dans la peau. Un tel objectif, difficile mais pas impossible à atteindre, exigerait la construction de systèmes faisant intervenir différents régulateurs et nécessiterait la modification d’un nombre important de gènes. »
Une règlementation européenne inadaptée
« L’édition des génomes apparaît clairement comme une méthode très intéressante en matière d’amélioration variétale, mais il s’agit, selon une décision de la Cour de Justice de l’Union Européenne, d’une technologie de modification génétique des organismes, au sens de « modification de la plante », bien que le résultat de l’opération ne soit pas un organisme génétiquement modifié puisque ne subsiste dans la plante aucun élément exotique, aucun gène de résistance à un antibiotique ni aucune séquence ou portion de séquence étrangère au génome d’origine. Pour cette raison, il semble légitime de considérer que cette technologie devrait être soumise à une règlementation différente de celle des OGM « classiques ».
 L’an dernier, la communauté des sélectionneurs et des généticiens dans son ensemble s’est déclarée surprise et déçue lorsque la technologie d’édition des génomes a été placée dans le cadre d’application des lois régissant les OGM par la Communauté Européenne. Il sera donc très difficile et onéreux d’obtenir ces matériels en Europe, alors qu’aux Etats-Unis et dans beaucoup d’autres pays, la règlementation concerne non pas la technologie d’obtention mais le matériel végétal final obtenu. Dans ce contexte, le produit peut être considéré comme OGM et à ce titre autorisé ou non, tandis que la méthode d’obtention ne fait pas l’objet de ce type de restrictions ».
L’an dernier, la communauté des sélectionneurs et des généticiens dans son ensemble s’est déclarée surprise et déçue lorsque la technologie d’édition des génomes a été placée dans le cadre d’application des lois régissant les OGM par la Communauté Européenne. Il sera donc très difficile et onéreux d’obtenir ces matériels en Europe, alors qu’aux Etats-Unis et dans beaucoup d’autres pays, la règlementation concerne non pas la technologie d’obtention mais le matériel végétal final obtenu. Dans ce contexte, le produit peut être considéré comme OGM et à ce titre autorisé ou non, tandis que la méthode d’obtention ne fait pas l’objet de ce type de restrictions ».
Pour l’instant, à moins que la recherche ne mette en évidence une impasse naturelle totale (comme une maladie pour laquelle aucune résistance naturelle n’a été identifiée) pour laquelle le recours aux biotechnologies constituerait l’unique solution, un changement de la législation européenne est peu probable. Dans le même temps, il subsiste la question de la capacité de la science et des pouvoirs publics à identifier un produit issu des méthodes d’édition des génomes CRISPR. Pour Mathilde Causse, la distinction est pratiquement impossible, dès lors que « la modification peut ne porter que sur une seule base parmi plusieurs millions de polymorphismes présents dans la variété », alors que les traces de modification génétique traditionnelle peuvent être détectées. Cette exigence de la loi européenne signifie que les sélectionneurs devront disposer de variétés spécifiques destinées au marché européen, qui ne sortiront jamais de cet espace. De plus, ils devront donc impérativement veiller à ne jamais introduire de variétés provenant des USA, de Chine, d’Australie, ou d’autres pays extérieurs à l’UE. Une telle séparation des filières au niveau mondial posera immanquablement un jour la question des flux de produits frais (et peut-être aussi transformés), de leurs contrôles entre pays régis par des législations différentes, et de la distorsion de concurrence qu’induira inévitablement le retard imposé par la décision politique aux filières industrielles des semences…
Quelques informations complémentaires
Pour mieux connaître Mathilde Causse et ses travaux :
Les outils du sélectionneur
Cet article fait référence à la Conférence Tomato News qui s'est tenue à Avignon (Fr) les 16 et 17 mai 2019, pendant laquelle le rapport annuel « 2019 Processed Tomato Yearbook » a été distribué aux participants.
Un exemplaire de ce livre peut être acheté sur ce site (consulter la page GET LISTED), ou vous pouvez compléter et renvoyer le bon de commande : order form.
Source : Conférence Tomato News, Interview Mathilde Causse (INRA)